ЖЕСТКОСТЬ ВОДЫ, совокупность св-в
воды
, обусловленная наличием в ней преим.
катионов
Са2+ (кальциевая Ж. в.) и Mg2+ (магниевая Ж. в.). Один из возможных их источников - горные
породы
(известняки, доломиты), к-рые растворяются в результате контакта с прир.
водой
. Сумма
концентраций
Са2+ и Mg2+ наз. общей Ж. в. Она складывается из карбонатной (временной, устраняется кипячением) и некарбонатной (постоянной) Ж. в. Первая вызвана присутствием в
воде
гидрокарбонатов Са и Mg [при кипячении разлагаются на СаСО3 и Mg(OH)2 с выделением СО2], вторая - наличием сульфатов,
хлоридов
,
силикатов
, нитратов и фосфатов этих
металлов
.
В СССР Ж. в. выражают в ммоль экв/л: карбонатная жесткость отвечает той части
катионов Са2+ и Mg2+, к-рая эквивалентна содержащимся в
воде
анионам НСО3
-
, некарбонатная -
анионам SO42
-
, NO3
-
и др. (1 ммоль экв/л соответствует 20,04 мг/л
катионов Са2+ или 12,16 мг/л
катионов Mg2+). В др. странах для выражения Ж в. часто используют т. наз. градусы жесткости. Напр., Г жесткости немецкий, соответствующий 0,01 г СаО в 1 л
воды, равен 0,357 ммоль экв/л.
Ж. в. обычно определяют титрованием р-ром дигидрата динатриевой
соли этилендиаминтетрауксусной к-ты (комплексон III, трилон Б) в щелочной среде. При титровании с использованием комплексонометрич.
индикаторов находят: в присут. эриохрома черного Т (хромогеновый черный ЕТ) -общую Ж. в. (Жоб), в присут.
мурексида (пурпурат аммония) - кальциевую Ж. в. (ЖСа ). Магниевую Ж. в. определяют из выражения: ЖMg = Жоб - ЖCa. Если содержание
катионов Са2+ и Mg2+ в
воде было найдено др. методами, общую Ж. в. можно вычислить по ф-ле:
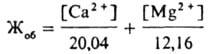
Ж. в. колеблется в широких пределах: от 0,1-0,2 ммоль экв/л в реках и озерах, расположенных в зонах тайги и тундры, до 80-100 ммоль экв/л и более в подземных водах, морях и океанах. Различают воду мягкую (общая жесткость до 2 ммоль экв/л), средней жесткости (2-10 ммоль экв/л) и жесткую (более 10 ммоль экв/л). В поверхностных водоисточниках, где преобладает, как правило, карбонатная жесткость (70-80% от общей), а магниевая жесткость обычно не превышает 30%, реже 60% от общей, наиб. значения Ж. в. достигает в конце зимы, наименьшего - в период паводка. Так, в Волге (г. Горький) макс. Ж. в. бывает в марте (4,3 ммоль экв/л), минимальная - в мае (0,5 ммоль экв/л). В подземных водах Ж. в. более постоянна и меньше изменяется в течение года. Повыш. Ж. в. способствует усиленному образованию накипи в паровых котлах, отопит. приборах и бытовой метал-лич. посуде, что значительно снижает интенсивность теплообмена, приводит к большому перерасходу топлива и перегреву металлич. пов-стей. Ж. в. увеличивает расход мыла при стирке, поскольку часть его образует с катионами Са2+ нерастворимый осадок. Качество тканей, стираемых в жесткой воде, и тканей, при отделке к-рых она применяется, ухудшается вследствие осаждения на тканях кальциевых и магниевых солей высших жирных к-т мыла. В воде с высокой жесткостью плохо развариваются овощи и мясо, т. к. катионы Са2+ образуют с белками пищ. продуктов нерастворимые соединения. Большая магниевая жесткость придает воде горький привкус, поэтому содержание катионов Mg2+ в питьевой воде не должно превышать 100 мг/л. Общая жесткость питьевой воды во избежание ухудшения ее органолептич. св-в должна быть не более 7 ммоль экв/л; по согласованию с органами санитарно-эпидемиологич. службы иногда допускается увеличение общей Ж. в. до 10 ммоль экв/л. Для устранения или уменьшения Ж. в. применяют спец. методы. Напр., из реагентных методов наиб. распространен известково-содовый, к-рый позволяет устранить карбонатную и некарбонатную Ж. в. С помощью ионообменных методов умягчают воду с преобладающей некарбонатной Ж. в. (Na+-катионирование) или карбонатной (Н+-катионирование); комбинированием этих методов получают глубоко умягченную воду. См. также Антинакипины, Вода, Водоподготовка.
===
Исп. литература для статьи «ЖЕСТКОСТЬ ВОДЫ»: Руководство по химическому анализу поверхностных вод суши, под ред. А. Д. Семенова. Л., 1977; Унифицированные методы исследования качества вод. ч. 1. Методы химического анализа вод. кн. 1, 2, 3 изд.. М., 1977; Лурье Ю. Ю., Аналитическая химия промышленных сточных вод. М., 1984. В. А. Гладков.
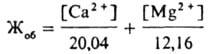
Ж. в. колеблется в широких пределах: от 0,1-0,2 ммоль экв/л в реках и озерах, расположенных в зонах тайги и тундры, до 80-100 ммоль экв/л и более в подземных водах, морях и океанах. Различают воду мягкую (общая жесткость до 2 ммоль экв/л), средней жесткости (2-10 ммоль экв/л) и жесткую (более 10 ммоль экв/л). В поверхностных водоисточниках, где преобладает, как правило, карбонатная жесткость (70-80% от общей), а магниевая жесткость обычно не превышает 30%, реже 60% от общей, наиб. значения Ж. в. достигает в конце зимы, наименьшего - в период паводка. Так, в Волге (г. Горький) макс. Ж. в. бывает в марте (4,3 ммоль экв/л), минимальная - в мае (0,5 ммоль экв/л). В подземных водах Ж. в. более постоянна и меньше изменяется в течение года. Повыш. Ж. в. способствует усиленному образованию накипи в паровых котлах, отопит. приборах и бытовой метал-лич. посуде, что значительно снижает интенсивность теплообмена, приводит к большому перерасходу топлива и перегреву металлич. пов-стей. Ж. в. увеличивает расход мыла при стирке, поскольку часть его образует с катионами Са2+ нерастворимый осадок. Качество тканей, стираемых в жесткой воде, и тканей, при отделке к-рых она применяется, ухудшается вследствие осаждения на тканях кальциевых и магниевых солей высших жирных к-т мыла. В воде с высокой жесткостью плохо развариваются овощи и мясо, т. к. катионы Са2+ образуют с белками пищ. продуктов нерастворимые соединения. Большая магниевая жесткость придает воде горький привкус, поэтому содержание катионов Mg2+ в питьевой воде не должно превышать 100 мг/л. Общая жесткость питьевой воды во избежание ухудшения ее органолептич. св-в должна быть не более 7 ммоль экв/л; по согласованию с органами санитарно-эпидемиологич. службы иногда допускается увеличение общей Ж. в. до 10 ммоль экв/л. Для устранения или уменьшения Ж. в. применяют спец. методы. Напр., из реагентных методов наиб. распространен известково-содовый, к-рый позволяет устранить карбонатную и некарбонатную Ж. в. С помощью ионообменных методов умягчают воду с преобладающей некарбонатной Ж. в. (Na+-катионирование) или карбонатной (Н+-катионирование); комбинированием этих методов получают глубоко умягченную воду. См. также Антинакипины, Вода, Водоподготовка.
===
Исп. литература для статьи «ЖЕСТКОСТЬ ВОДЫ»: Руководство по химическому анализу поверхностных вод суши, под ред. А. Д. Семенова. Л., 1977; Унифицированные методы исследования качества вод. ч. 1. Методы химического анализа вод. кн. 1, 2, 3 изд.. М., 1977; Лурье Ю. Ю., Аналитическая химия промышленных сточных вод. М., 1984. В. А. Гладков.


